АФФИНАЖ
Сколь много жизней в этом слове...
Аффинаж - (франц . affinage,
от affiner - очищать),
получение благородных металлов высокой чистоты. Аффинаж
является всего лишь одной из разновидностей процесса
рафинирования, т.е. очистки металлов. Методы аффинажа
разделяются на электролитические, мокрые и сухие.
Электролитические методы применяются в основном для
аффинажа золота и серебра; состоят в осаждении чистого металла
на катоде с одновременным выделением примесей в виде шлама.
Золото, полученное по этому методу, имеет пробу не ниже
999,9‰. Преимущество электролитических методов аффинажа
заключается в более низкой стоимости процесса, высокой степени
очистки металлов, благоприятных условиях для работающих и
возможности получения металлов платиновой группы в качестве
побочных продуктов (при добавлении к отработанному электролиту
химических агентов).
Мокрые методы аффинажа применяются для получения
серебра, золота, платины, палладия, иридия, родия и других
металлов этой группы по сложной схеме с растворением металлов
в царской водке и последовательным выделением их из раствора
различными реагентами (хлористый аммоний, аммиак, сахар и
др.).
Царская водка, смесь концентрированных кислот —
соляной HCI и азотной HNO3 (3: 1 по объёму).
Жидкость жёлтого цвета, пахнущая хлором и окислами азота.
Обладает сильной окислительной способностью, обусловленной
выделением хлора в результате реакций:
3HCI + HNO3
= CI2 + NOCI + 2H2O
2NOCI = 2NO +
CI2.
Данная смесь кислот растворяет почти все металлы (в их числе и Au - отсюда название "царская водка" данное алхимиками, которые считали золото "царём металлов"), исключение же составляют: серебро Ag; родий Rh и иридий Ir.
“Царская водка” применяется: как реактив в
химических лабораториях и при определении “пробы” золотых
сплавов; при аффинаже Au и Pt; для получении
хлоридов металлов и в других целях.
Сухие методы аффинажа золота состоят в обработке
расплавленного металла, как правило, хлором. При этом все
неблагородные металлы образуют хлориды и улетучиваются, а
хлорид серебра всплывает на поверхность чистого расплавленного
золота. Проба золота 996,5‰, а серебра (при восстановлении его
из хлоридов) – 999,0‰.
Аффинаж в промышленности есть процесс
отделения металлов (золота, платины, серебра) от примесей с
целью получения конечного продукта высокой пробы.
Проба (нем. Probe,
от лат. probo – испытываю,
оцениваю) благородных металлов, количественное
содержание золота, серебра, платины или палладия в лигатурном
сплаве, из которого изготовляются ювелирные изделия,
зубопротезные диски, монеты, медали и др.
В большинстве стран принята метрическая система обозначения
пробы, в СССР она введена 15 ноября 1927. По этой системе
проба обозначается числом частей благородного металла в 1000
частях (по массе) лигатурного сплава. По каратной системе,
принятой в США, Великобритании и Швейцарии, 1000‰ проба
металла соответствует 24 условным единицам, называемым
каратами. До 1927 в России существовала золотниковая система
обозначения пробы (на основе русского фунта, содержащего 96
золотников), по которой проба выражалась весовым количеством
металла в 96 единицах сплава. Проба сплавов благородных
металлов, из которых разрешается изготовлять ювелирные и др.
изделия, устанавливаются законодательным путём. Проба
гарантируется государством, для чего изделия обязательно
проходят пробирный контроль (опробование и анализ) и на них
накладываются оттиски пробирных клейм. Слитки благородных
металлов клеймятся пробой, определённой в сплаве. Не подлежат
клеймению ордена, наградные медали и монеты, хотя проба их
сплавов строго регламентирована и контролируется. Контроль за
пробой сплавов и изделий выполняется инспекциями пробирного
надзора.
В России государственное клеймение изделий узаконено:
серебряных – в 1613, золотых – в 1700; в СССР: платиновых – в
1927, палладиевых – в 1956.
Лигатура в металлургии, вспомогательные сплавы,
применяемые для введения в жидкий металл лигатурных элементов.
Лигатурой называют также металлы, которые вводятся в
благородные металлы (золото, серебро и др.) для придания им
нужных свойств (например, твёрдости) или удешевления изделий.
В качестве лигатуры применяются медь, никель и др. металлы.
Однако, если аффинаж
– термин присущий непосредственно методам технологической
переработки касающихся именно очистки благородных металлов, то
вот рафинирование
металлов – есть процесс более обобщенный для ряда
технологических манипуляций применяемых в металлургической и
горнодобывающей отраслях. Но служащий также для целей очистки
металлов от всевозможных примесей и для разделения добываемых
металлов.
В основном, черновые металлы, получаемые из сырья, содержат
96-99% основного металла, остальное приходится на примеси.
Такие металлы не могут использоваться промышленностью из-за
низких физико-химических и механических свойств. Примеси,
содержащиеся в черновых металлах, могут представлять
самостоятельную ценность. Так, стоимость золота и серебра,
извлекаемых из меди, полностью окупает все затраты на
рафинирование. Различают три основных метода рафинирования:
пирометаллургический, электролитический и химический. В основе
всех методов лежит различие свойств разделяемых элементов:
температур плавления, плотности, электроотрицательности
химической активности и т.д. Для получения чистых металлов
нередко используют последовательно несколько методов
рафинирования.
Пирометаллургическое рафинирование, осуществляемое при
высокой температуре в расплавах, имеет ряд разновидностей.
Электролитическое рафинирование, представляющее собой
электролиз водных растворов или солевых расплавов, позволяет
получать металлы высокой чистоты. Применяется для глубокой
очистки большинства цветных металлов.
Химическое рафинирование основано на различной
растворимости металла и примесей в растворах кислот или
щелочей. Примеси, постепенно накапливающиеся в растворе,
выделяются из него химическим путём (гидролиз, цементация,
образование труднорастворимых соединений, очистка с помощью
экстракции или ионного обмена). Частным примером химического
рафинирования может служить аффинаж благородных металлов.
Рафинирование золота производят в кипящей серной или азотной
кислоте. Примеси Cu, Ag и
др. металлов растворяются, а очищенное золото остаётся в
нерастворимом осадке.
Так же нужно обратить и особое внимание и на прочие методы
химического рафинирования, потому как всё дальнейшее
повествование непосредственно об аффинаже, в той или иной мере
коснётся каждого из ниже перечисленных процессов:
Цементация в цветной металлургии,
гидрометаллургический процесс, основанный на вытеснении более
электроположительных металлов из растворов их соединений менее
электроположительными металлами, находящимися в твёрдом
состоянии. Например, нормальный электрохимический потенциал
меди + 0,344 в, цинка - 0,762 в; эта разность
потенциалов позволяет осуществлять реакцию Cu2+раствор
+ Znмeталл –> Zn2+раствор
+ Cuмeталл. Чем больше
разность потенциалов, тем меньше остаточное содержание в
растворе осаждаемого металла. Цементация широко применяют для
очистки растворов от примесей и для извлечения металлов из
растворов. Процесс может быть применен также для осаждения
металлов из расплавленных шлаков.
Экстракция (от позднелат.
extractio – извлечение),
экстрагирование, процесс разделения смеси жидких или твёрдых
веществ с помощью избирательных (селективных) растворителей
(экстрагентов).
Ионный обмен, обмен ионов в растворах электролитов (гомогенный
ионный обмен). При смешении разбавленных растворов
электролитов, например NaCl и KNO3 в смеси
присутствуют ионы Na+,
К+, NO3– и Cl–.
Равновесное состояние выразится в этом случае уравнением:
(реакция двойного обмена). Если одно из веществ, могущих
получиться при взаимодействии, диссоциировано меньше других,
равновесие сдвигается в сторону образования
малодиссоциированного вещества. Равновесие сдвигается также в
сторону образования летучего или малорастворимого продукта
(если он выделяется из данной фазы) по реакциям:
![]()
![]()
При выпаривании равновесного раствора, прежде всего, начинается кристаллизация соли (комбинации ионов), обладающей меньшей растворимостью.
К благородным металлам
относятся серебро, золото и две триады металлов
платиновой группы: рутений, родий, палладий
- лёгкие и платина, иридий, осмий - тяжёлые платиновые
металлы.
Безусловно, самыми распространёнными в быту, медицине и
технике из всех существующих благородных металлов, являются
серебро и золото. Палладий, платина и иридий имеют широкое
применение в технике и медицине, однако, мало кто знаком с тем
фактом, что практически каждодневно просто "сжигает" в своём
авто платину и палладий, но обо всём по порядку:
Серебро (Argentum). Атомная
масса серебра 107,868; плотность при 20°С 10,49 г/см2;
температура плавления 960,8°С; температура кипения 2160°С.
Содержание серебра в земной коре составляет всего 10-5%(масс.).
В некоторых местах (например, в Канаде) серебро встречается в
самородном состоянии, но большую часть серебра получают из его
соединений. Самой важной серебряной рудой является серебряный
блеск, или аргентит, Ag2S.
В качестве примеси серебро присутствует почти во всех медных и
особенно свинцовых рудах. Из этих руд и получают около 80%
всего добываемого серебра.
Серебро добывалось человеком с давних времен и широко
использовалось для украшений, бытовой утвари и денежного
обращения. В начале 20 в. потребление серебра в
валютно-финансовых целях сильно сократилось в связи с
переходом ряда стран на золотой стандарт, но увеличилось
использование его в различных отраслях промышленности
(особенно резко во 2-й половине столетия в период и после 2-й
Мировой войны).
Главным потребителем серебра являются фото- и кинематография,
рентгенография и другие отрасли использования фотоматериалов.
Широко используется серебро в электротехнике, электронике,
радиотехнике и связанных с ними отраслях машиностроения.
Важным потребителем серебра являются ракетная, космическая и
авиационная техника, военно-морской флот, производство
серебро/цинковых и серебро/кадмиевых аккумуляторов, а также
первичных источников тока. Большое количество серебра
используется для изготовления припоев, в химической
промышленности и в химическом машиностроении.
В настоящее время более 70% серебра расходуется на
промышленные цели, т.е. из металла, служившего главным образом
для производства монет, украшений и бытовой утвари, серебро
превратилось в "промышленный" металл.
В 1950-60-х годах в связи с резко возросшим потреблением
серебра возник разрыв между производством и потреблением
серебра с превышением последнего в 3000-4500 т. в год.
Образовавшийся дефицит в производстве серебра покрывался за
счет использования запасов в казначействах, переплавки монет,
скупки изделий и т.д. Одновременно принимались меры по
увеличению производства первичного серебра путем
предоставления ряда существенных льгот предприятиям,
добывающим серебро.
В
На практике чистое серебро вследствие мягкости почти не
применяется: обычно его сплавляют с большим или меньшим
количеством меди. Сплавы серебра служат для изготовления
ювелирных и бытовых изделий, монет, лабораторной посуды и
медицинских принадлежностей.
В стоматологии широкое применение имеют серебряные припои (в
частности СПрС-37 и Цитрина), штифты серебряные (с содержанием
серебра до 90%) и серебряно-палладиевые сплавы для
изготовления коронок, вкладок и прочих литых конструкций. Для
пломбирования зубов широко применяется серебряная амальгама.
Используемые в стоматологии серебряные сплавы бывают очень
разнообразны по своему составу. Например, припои серебряные:
1). Серебра 60%, меди 30%, цинка 10%. 2). Серебра 50%, меди
30%, цинка 20%. 3). Серебра 20%, меди 10%, цинка 20%. 4).
Серебра 10%, меди 40%, цинка 20%.
Серебряно-оловянные сплавы с пониженной температурой
плавления, применяемые для вкладок: 1) серебра 90%,
олова 10% (точка плавления 900°); 2). Серебра 65%, олова 35%
(точка плавления 430°).
Сплавы серебряно-палладиевые: 1). Серебра около 75%, палладия
около 25%. 2). Серебра около 79%, палладия около 21%. 3).
Серебра около 85%, палладия около 15%. 4). Серебра
Сплав серебряно-оловянно-платиновый: серебра 89%, олова 10%,
платины 1% (точка плавления 900°).
Сплавы на серебряной и палладиевой основе имеют белый цвет,
содержат 60-70% серебра, 20-30% палладия. Некоторые сплавы
содержат более 5% золота. Кроме того, в состав сплава может
быть введено небольшое количество никеля, железа, хрома,
магния и др. Общее количество примесей к серебру и палладию не
должно превышать 10%, в противном случае резко снизится
коррозийная стойкость сплава.
Однако в промышленных масштабах основными поставщиками
серебросодержащего вторичного сырья являются фото- и
кинопромышленность, химическая, электротехническая и
радиопромышленности, зеркальное, часовое и ювелирное
производства, лечебные учреждения (стоматология является
исключением этого списка).
Все отходы благородных металлов можно разделить на два вида
сырья:
1) металлическое - серебросодержащие соры
и золы, оксидные соединения серебра, серебро электролизное,
серебросодержащие бракованные изделия и детали, бракованные
полуфабрикаты в виде слитков, проката, проволоки, заготовок,
порошков или их отходы; крупные серебряно-цинковые
аккумуляторы, бракованные или вышедшие из строя;
малогабаритные серебряно-цинковые аккумуляторы и др.;
2) неметаллическое - бромистое, сернистое, хлористое серебро;
шламы фиксажных растворов и шламы зеркального производства;
серебросодержащие соры, шлифы,
зола кино-, фото- и рентгенопленки; катализаторы
серебряно-пемзовые и др.; серебросодержащие шлаки.
Кроме перечисленных отходов на переработку поступают и другие
виды сырья, резко различающиеся химическими и физическими
свойствами.
Для извлечения серебра, как впрочем, и других благородных
металлов из технических отходов (вторичного сырья), существует
множество разнообразных способов и технологий. Но, безусловно,
практическое значение при определённых условиях и отсутствия
сложной аппаратуры, доступны лишь немногие из них, на которых
и следует остановиться несколько более подробно.
I. Сухие методы аффинажа серебра
1. Способ купелирования.
Сплавы серебра с низкой пробой аффинируются при помощи
купелирования (окисление сплава серебряно-содержащих отходов
со свинцом) для чего используется печь с тиглем в виде чашки,
называемый пробирным тиглем. Этот метод основан на свойстве свинца расплавленного с серебром
окисляться на воздухе, отделяясь от металла вместе с
посторонними примесями. Не отделяется только золото, платина и
другие металлы семейства платины, которые остаются в сплаве с
серебром. Печь покрыта мергелью -
пористой известняковой глиной, которая поглощает окись свинца,
испаряющийся из жидкого сплава под воздействием потока
воздуха. После завершения окисления и перехода свинца в окись,
поверхность сплава принимает радужную окраску, через которую
при растрескивании прорывается яркий блеск серебра. Этот блеск
указывает на окончание аффинажа.
2. Метод соды.
Сухой хлорид перемешивается с равным весом карбоната натрия,
смесь нагревается в тигле, наполненном не более чем на
половину, так как масса выделяет газ и увеличивается в объеме.
После окончания выделения газа температура поднимается до
температуры спокойного плавления. Смесь охлаждается, металл
вынимается, плавится еще раз и отливается. Преимущество этого
метода заключается в быстром получении металла, однако сода
разрушающее действует на тигель.
II. Мокрые методы аффинажа серебра
1. Химические способы извлечения
серебра из лабораторных и технических остатков.
1). Остатки растворимых солей
серебра подкисляют НСl, добавляют
гранулированный цинк и кипятят. Восстановившееся серебро
отделяют и промывают с применением декантации. Если желают
получить очень частое серебро, то восстановленное серебро
растворяют в HNO3, осаждают соляной кислотой в виде
AgCl. Образовавшийся хлорид
серебра промывают и восстанавливают формалином до
металлического серебра.
2). Остатки с содержанием
соединений серебра выпаривают досуха и полученную
массу кипятят с концентрированной НСl
и KClO3 (из расчета
З). Серебросодержащие сплавы
металлов (лом изделий, остатки серебряных припев,
стружки, опилки и прочее…) полностью растворяют в азотной
кислоте HNO3. В получившийся раствор порционно
добавляют соляную кислоту НСl, до
прекращения образования белого хлопьевидного осадка хлористого
серебра. Осадок AgCl несколько раз тщательно промывают и
отстаивают, затем его заливают 10%-ным раствором HCl. В получившуюся рыхлую смесь
кислоты и хлорида серебра опускают несколько кусочков железа
(лучше использовать низкоуглеродистые сплавы оного – гвозди и
т.п…), введенный железный лом
должен быть целиком покрыт раствором соляной кислоты. При этом
практически сразу же начинается реакция восстановления
металлического серебра. Когда AgCl
полностью прореагирует (что определяется полным отсутствием
белого хлорида серебра и по обильному вспенивающемуся
выделению водорода из смеси), железо вынимают. Остатки
кислотного раствора аккуратно сливают и основательно промывают
проточной водой полученное порошкообразное серебро. Полученный
металл высушивают и, при необходимости, сплавляют.
2. Химические способы извлечения
серебра из отработанных фиксажных растворов.
1). Сульфидный способ
Важнейшим неметаллическим реагентом для извлечения серебра
является сернистый натрий Na2S • 9Н2О.
Из всех реагентов, предложенных для осаждения серебра, он
наиболее доступен, дешев и надежен по полноте и быстроте
протекания реакции, которая описывается уравнением
2Na5[Ag(S2O3)3]
+ Na2S = Ag2S + 6 Na2S2O3.
Сульфидный способ осаждения серебра основан на малом значении
произведения растворимости
2[Ag+][S2-]=6,3•10-50.
Концентрация серебра в насыщенном водном растворе сульфида
серебра составляет около 5 • 10-15 г/л. В растворе
гипосульфита она резко возрастает за счет образования
комплексов, но все же достигает только величин порядка сотых
долей миллиграмма в литре.
Реакция осаждения Ag2S в условиях перемешивания
протекает практически мгновенно и до конца. Однако Ag2S
выпадает в виде очень тонких частиц, длительность отстаивания
которых велика (десятки часов). Скорость отстаивания зависит
от дисперсности частиц, которая определяется исходной
концентрацией серебра в растворе и зарядом частиц Ag2S.
Чем ниже исходная концентрация серебра, тем дисперсией частицы
Ag2S и тем медленнее идет отстаивание. При
повышении температуры раствора до 70-80°С скорость отстаивания
многократно увеличивается.
Расход технического сернистого натрия составляет
2). Гидросульфитный способ
Гидросульфит натрия представляет собой кристаллогидрат Na2S2O4
• 2Н2О. Осаждение серебра гидросульфитом натрия
протекает по реакциям
2Na5[Ag(S2O3)3]
+ Na2S2O4 = 2Ag + 2SO2
+ 6Na2S2O3;
2Na5[Ag(S2O3)3]
+ Na2S2O4 = Ag2S +
Na2SO4 + Na2S4O4
+ 4Na2S2O3
Реакции протекают медленней, чем при сульфидном способе и
требуют подогрева и перемешивания. Серебро осаждается из
растворов полностью. Осадок состоит из смеси металлического и
сернистого серебра с содержанием до 80% Ag.
Для осаждения
Основное преимущество этого способа заключается в образовании
более компактного и легко фильтруемого осадка.
Восстановление металлического серебра из сернистого серебра
осуществляется методом плавки шихты состоящей из смеси
сульфида серебра и кальцинированной соды.
При плавке сернистого серебра первая реакция восстановления
серебра также обеспечивается взаимодействием с
кальцинированной содой:
2Ag2S + 4Na2CO3 —> 8Ag + 3
[Na2S • Ag2S] + Na2SO4
+ 4СО2.
Далее для восстановления серебра из соединения Na2S
• Ag2S в расплав вводят железо и происходит
окончательное вытеснение серебра из сульфида:
Na2S • Ag2S + Fe
—> FeS • Na2S +
2Ag.
3). Осаждение серебра формалином
Формалин СНСОН) применяется в виде 40%-ного раствора. Он в
обычных условиях не разлагается и полностью осаждает серебро
из фиксажных растворов. Однако удельный расход формалина
значительно больше, чем расход других применяемых для
осаждения серебра реагентов.
4). Осаждение серебра ронгалитом
Ронгалит представляет собой формальдегид-сульфоксилат
натрия
CH2•NaHSO3•H2O.
При осаждении к фиксажному раствору добавляют ронгалит в
тонком порошке в количестве
III Электролитический метод
Электролитический аффинаж серебра производится в ячейках из
песчаника или пластика, содержащих раствор нитрата серебра с
содержанием серебра до 50 г/л, азотную кислоту 1,5 г/л;
плотность тока 2 А/дм2; аноды изготавливаются из
загрязненного серебра, катод - из тонких полосок нержавеющей
стали. Аноды помещаются в мешочки из ткани, в которых
собираются нерастворимые частицы загрязняющее серебро,
избежавшие электрохимического растворения. На катоде
откладывается серебро в виде макрокристаллов, которые растут в
сторону противоположного полюса вплоть до короткого замыкания.
Для того чтобы избежать этого, ветви кристаллов ломаются при
перемешивании раствора в направлении параллельном электродам
на небольшом расстоянии от катода. Кристаллы падают в корзину
на дне, откуда периодически удаляются. Полученные кристаллы
затем отливаются в слитки. В электролите собирается, прежде
всего, медь, при достижении определенной концентрации медь
начинает так же откладываться на катоде, поэтому электролит
необходимо периодически менять.
Золото (Aurum). Атомная
масса золота 196,967; плотность при 20°С 19,32 г/см3;
температура плавления 1063°С; температура кипения 2966°С.
Ученые считают, что человек познакомился с золотом в глубокой
древности. Металл привлек наших пращуров своей ковкостью и
цветом – цветом Солнца, которому и поклонялся абстрактный
прародитель. Золото стало символом богатства и могущества, да
так до сих пор и манит человека своим блеском.
В компактной форме золото представляет собой мягкий желтый
металл, отличающийся самой высокой по сравнению со всеми
остальными элементами пластичностью и ковкостью; так, 28г
золота можно расплющить в лист площадью 28м2, а
получившаяся фольга из него столь тонка, что пропускает
видимый свет.
Изучение солнечного спектра показало, что относительное
содержание золота на Солнце составляет 0,04 млн-1,
тогда как среднее относительное содержание золота в земной
коре равно примерно 0,004 млн-1 (вероятно,
содержание золота в земном ядре выше, чем в коре).
Экономически добыча золота оправдана только при условии его
концентрирования в 103 раз, но в таком случае
золото не было бы золотом, т.е. неким мерилом ценности всех
стран и народов.
Однако человечество ещё со времён алхимиков всегда делала
попытки как-то раздобыть этот металл с наименьшими затратами.
А с тех пор, как в процессе развития товарного обращения
золото стало мерилом стоимости (деньгами) и объектом
накопления, его история неразрывно связана с кровопролитными
войнами, колониальными захватами и грабежами народов. Наиболее
характерным примером этого является колониальная экспансия
испанских завоевателей Америки в 15-16 вв., в результате
которой были уничтожены древнейшие цивилизации инков, ацтеков
и майя.
В 17 веке мировая добыча золота росла главным образом за счет
Бразилии (1681-1760 гг.), в которой были открыты богатые
россыпи. В 1-й половине 19 в. в лидеры выдвинулась Россия в
результате открытия и разработки россыпных месторождений Урала
и Сибири. В связи с ростом торгового капитала, развитием
техники и промышленности возрос спрос на валютные металлы -
золото и серебро, что стимулировало поиск новых месторождений
этих металлов и совершенствования технологий добычи и
извлечения металлов из руд.
В начале прошлого века писатель фантаст А.Н. Толстой в своём
бессмертном произведении "Гиперболоид инженера Гарина" даже
предложил при помощи чудо луча дорыться-таки до ядра Земли
лишь с целью добыть золото с максимально экономической выгодой
и тем самым завоевать весь мир, обесценив его. Но если Толстой
всего лишь фантазировал в 1925 году, то сегодня ведутся
полноценные разработки направленного
атомного взрыва устремлённого в земные недра,
практически для тех же целей.
В природе золото обычно встречается в виде металла, причем
известны два пути его концентрирования. Это, во-первых,
образование аллювиального, или россыпного, золота в результате
выветривания золотоносных горных пород и снесения продуктов их
выветривания в русла рек или в результате аналогичных
склоновых процессов. Золото начали добывать уже в конце
каменного века (8000-12000 лет до н.э.), используя для
украшений и производства разных бытовых изделий. Золото было
известно в Египте за 12000 лет до н.э. и широко применялось
там за 4000 лет до н.э. Поскольку плотность золота (19,3 г/см3)
значительно больше, чем у остаточных продуктов выветривания
коренной породы (~2,7 г/см3), золото оседает в
русле, тогда как более легкие фракции сносятся водой. Из уже
открытых аллювиальных месторождений золото часто можно
сравнительно легко добывать в виде самородков или зерен с
помощью простого гравитационного обогащения.
Большинство месторождений золота, обнаруженных на Урале, также
относится к россыпным аллювиальным месторождениям. Наиболее
крупные коренные месторождения золота обнаружены в Южной
Африке, где золото встречается в виде тонких прожилок в
кварцитах.
Золото считается инертным металлом, но в присутствии
окислителей оно легко переходит в раствор с образованием
комплексов золота (III) или золота (I). Особенно интересно,
что некоторые микроорганизмы и их метаболиты, выделенные из
золотоносных отложений, способны растворять золото. Выделенные
бактериальные метаболиты, как установлено, способны растворить
за 20 дней до 10-35 г/м3 золота. Растворению
способствует присутствие аспарагиновой кислоты, гистидина, серина, аланина
и глицина, а также веществ, окисляющих металлы.
Единственными соединениями золота, встречающимися в виде
важных минералов, являются теллуриды.
К ним относятся калаверит и креннерит, представляющие собой разные
кристаллические формы АuТе2, монтбрайит
Аu2Те3 и смешанные теллуриды
серебра и золота, например сильванит AuAgTe4.
Самородное золото содержит также переменные количества
серебра; хорошо известен природный сплав золота и серебра электрум, содержащий около 20%
серебра. Из золотых руд извлекают и другие сопутствующие
золоту ценные элементы - иридий, осмий, платину, родий,
рутений, палладий, а также медь и никель.
Присутствие в морской воде растворенного золота установлено
еще в
Большое значение для быстрого роста производства золота имело
промышленное использование цианистого процесса извлечения
золота из руд, открытого еще в
Извлечение золота из аллювиальных осадков с помощью
гравитационного обогащения было известно уже по меньшей мере
6000 лет назад. Золотоносный материал перемещался водой вниз
по желобу, снабженному наклонными канавками, в которых оседали
более тяжелые частицы золота. Считается, что использование для
этой операции шкур животных привело к возникновению легенды о
золотом руне Ясона и аргонавтах. В усовершенствованном
варианте этого метода в канавки помещали ртуть, которая
амальгамировала оседающие частицы золота, далее ртуть отгоняли
в ретортах и полученное золото в завершение переплавляли.
Эти методы не пригодны для извлечения золота из рудных
месторождений, в которых содержание его может составлять
только 10 млн-1 или меньше. Типичный современный метод
переработки таких руд заключается в следующем. Руду сначала
дробят, а затем размалывают до получения тонкоизмельчённой
массы, что необходимо для эффективного извлечения золота.
Часть золота до сих пор извлекают с помощью операций
гравитационного обогащения, амальгамирования, перегонки в
реторте и плавки, которые в современной технологии значительно
усовершенствованы. Отходы этих процессов не отправляют в
отвалы, а обрабатывают раствором цианида щелочного металла,
пропуская при этом через раствор сжатый воздух. В результате
следующей реакции оставшееся в породе золото растворяется:
4Аu + 8CN- + О2 + 2Н2O —>
4 [Au(CN)2]-
+ 4OН-
Полученный раствор фильтруют, чтобы отделить пустую породу, а
золото осаждают цинком
2[Au(CN)2]-
+ Zn —> [Zn(CN)4]2-
+ 2Au
Полнота извлечения золота таким комбинированным способом
достигает примерно 98%, а продукт, получаемый после
окончательной плавки, содержит 88-90% золота. Остальными
компонентами сплава являются серебро (~10%) и небольшие
количества меди, свинца, цинка, железа и металлов платиновой
группы.
Большую часть золота очищают методом хлорирования. Для этого
через расплавленное золото пропускают газообразный хлор, при
взаимодействии с которым серебро и неблагородные металлы
превращаются в хлориды, всплывающие на поверхность расплава,
откуда их легко удалить. Этим способом получают 99,5%-ное
золото; если необходима дальнейшая очистка, применяют
электролиз. Электролитом служит раствор Н[АuCl4] в
соляной кислоте; анод отливают из сырого, а катод из
очищенного золота. Чистое золото осаждается на катоде, а
платину и палладий можно извлечь из анодного шлама.
В лабораторных условиях, чтобы извлечь золото из
золотосодержащих остатков, их подвергают пиролизу, после чего
золото растворяют в царской водке. Далее доводят рН
полученного раствора до 2-4, прибавляя твердый гидроксид
натрия, и переосаждают золото,
используя в качестве восстановителя сульфит натрия.
Аналогичным способом можно получить из золота в компактной
форме золото в виде порошка.
В 20 в. мировая добыча золота развивалась неравномерно. После
быстрого роста в начале века резкое падение добычи золота
вызвала 1-я Мировая война 1914-18 гг. Уровень
Всего добыто золота с 1493 по 1999 гг. - 122000 т. Запасы
золота распределяются ориентировочно следующим образом: 60%
составляют официальные резервы, 20% - частная тезаврация и 20%
- в виде драгоценностей и промышленной продукции. Из общего
количества добываемого золота 35-65% идет на пополнение
официальных резервов и 15-45% - в частную тезаврацию.
Особая роль золота состоит в том, что оно является валютным
металлом. Золото выполняло функцию денег уже за 1500 лет до
н.э. Первоначально оно разрабатывали открытым способом, то
есть просто искали или мыли в долинах рек, размывавших
золотоносные жилы. Первым старателям Европы и Азии, вероятно,
везло относительно больше нашего, ведь золотые россыпи тогда
еще валялись буквально под ногами. Сомнения по этому поводу
может развеять Геродот, который с некоторой надменностью
описывал государство Лидия (на территории современной Турции),
которое "совсем ничем не обладает, разве, может быть, кроме
золотого песка, приносимого течением реки Тмола". Однако богатство последнего
царя Лидии Крёза вошло в поговорку.
Именно в Лидии в VI в. до н.э. начали чеканить первую в мире
монету – статер, из электрума (73% Au
- 27% Ag), естественного сплава
золота с серебром. Ранее золото обменивалось в виде слитков
или изделий, что затрудняло процесс торговли. Лидийцы придумали универсальный вид
существования золота на многие века. Конечно, первые лидийские
монеты не были вполне похожи на современные, потому что имели
выпуклую, а не плоскую форму. А в греческой колонии Ольвии (северный берег Черного моря) и
вовсе часть золотых монет имела вначале вид дельфина. И все же
процесс было не остановить.
Само слово "монета" произошло от одного из эпитетов римской
богини Юноны – Монета (советница), - в храме которой и был
организован первый римский монетный двор. Первой "мировой"
валютой тоже стал статер, но уже
не лидийский, а Александра Македонского после завоевания ряда
земель в Азии. Римские золотые монеты также выполняли роль
современных доллара или евро. Единичные находки римских монет
есть даже в нашем верхнем Поволжье, но севернее их уже нет
вовсе.
Первые золотые монеты Руси, златники,
были отчеканены при князе Владимире еще в далеком XI в.,
однако их было очень мало. На монете была примечательная
надпись: "Владимир, а се его злато", но на тот период на Руси
не было известных месторождений золота. Приходилось чеканить
монету из привозного сырья, а это было невыгодно. Долгое время
в России ходили арабские дирхемы, а попытка чеканить
собственную золотую монету была предпринята в 1610-1613 гг.,
Василием Шуйским, но вскоре потерпела неудачу. К началу XVIII
в. и петровских преобразований Россия подошла без своей
золотой монеты. Из золота изредка чеканились только
специальные наградные "червонцы", скорее выполнявшие функцию
медали или ордена. Первыми золотыми монетами из "домашнего
злата" стали двухрублевые монеты, которые тоже назывались
червонцами, отчеканенные в конце правления Петра I. Связано
это было с открытием мастером Иваном Мокеевым
первой в России химической лаборатории золота - "Купецкой
палатки", мастер сумел выделить из сибирского сплава серебра с
золотом последнее.
Не смотря на открытие в Сибири некоторых запасов золота,
золотая монета в Российской империи чеканилась не постоянно.
Относительного постоянства выпуска монет удалось достичь
только в середине XVIII в., с открытием рудных запасов золота
на Урале, что позволило постоянно выпускать монеты
достоинством в 2, 5 и 10 рублей, но и они не попадали в
широкий оборот, в основном используясь для нужд императорского
двора. Как и в Советском Союзе, государство не допускало к
разработке золотоносных недр частных лиц. Однако, как только
"государь соизволил" в
"Золотая лихорадка" позволила произвести министру финансов
Николая I Канкрину успешную
финансовую реформу. Основной золотой монетой стал империал
достоинством в 10 рублей. В
Но золото всегда было и не только мерилом богатства, золоту
поклонялись и приписывали магические силы. С древних времен
золото применяли для лечения всех болезней, причем в
тринадцатом веке aurum potabile (питьевое золото), вероятно,
было наиболее известным средством, пользовавшимся славой
панацеи, но только сравнительно недавно установлены реальные
основания для применения золота в химиотерапии. Главные
области применения золота в медицине - это лечение
ревматоидных артритов тиольными
соединениями золота(I) и радиотерапия радиоактивным изотопом 198Аu.
В настоящее время лечения ревматоидных артритов с применением
соединений золота известно обычно как "хризотерапия".
Приоритетными отраслями в медицине по значительному
использованию золота также являются стоматология и
косметология. На сегодняшний день мировая ортопедическая
стоматология является сомой претендующей отраслью медицины на
применение золотосодержащих сплавов.
В ортопедической стоматологии золото высоких проб применяют
для пломбирования полостей зуба (вкладки). Чистое золото
используется для метода когезивного
пломбирования полостей. Для коронок используют сплавы с медью,
серебром, платиной и цинком. Особую популярность в применении
всё шире находят "БИО-сплавы" – сплавы без содержания меди и
прочих нежелательных, с точки зрения биологического контакта с
тканями, металлов.
Когезия (от лат .
cohaesus - связанный,
сцепленный), сцепление друг с другом частей одного и
того же тела (жидкого или твердого). Обусловлена химической
связью и межмолекулярным взаимодействием. Сцепление
разнородных тел называется адгезией.
Золото в чистом виде для ортопедических конструкций не
применяется вследствие того, что оно слишком мягкое и поэтому
недостаточно прочное. Используются сплавы, которые именуются
лигатурным золотом. В сплав входят серебро, медь, платина и
палладий. Серебро, палладий и платина придают сплаву белый
оттенок, медь - красноватый. Добавление к золоту указанных
ингредиентов изменяет, кроме цвета, его свойства, точку
плавления, эластичность, (увеличивает твердость).
Применяемые в стоматологии золотоплатиновые сплавы для
изготовления металлокерамических конструкций очень
разнообразны по составу и процентному содержанию в них
благородных металлов. Вот составы лишь только некоторых из
них:
77,8%Au; 1,3%Ag; 9,5%Pt; 9,0%Pd; 0,3%Cu; 0,6%Sn; 1,2%In;
0,2%Fe; Ir, Ru
77,7%Au; 19,5%Pt; 2,0%Zn; 0,5%Ir; 0,3%Ta
78,5%Au; 10,0%Ag; 1,0%Pt; 1,5%Pd; 7,0%Cu; 0,5%Sn; 1,5%Zn
51,5%Au; 18,0%Ag; 26,6%Pd; 0,2%Cu; 2,7%Sn; 0,9%In; Ir, Ru
45,0%Au; 44,9%Pd; 3,0%Sn; 5,0%In; 2,0%Ga% Ir, Ru
10,0%Au; 57,0%Ag; 20,9%Pd; 10,0%Cu; 2,0%Zn; Ir, Ru
2,0%Au; 74,6%Pd; 9,3%Cu; 3,0%Sn; 0,2%Zn; 7,0%In; 3,5%Ga;
0,4%Ru
1,6%Au; 78,0%Pd; 10,8%Cu; 0,2%Sn; 0,2%Zn; 1,3%In; 7,5%Ga;
0,4%Ru
2,0%Au; 78,6%Pd; 9,8%Cu; 0,2%Zn; 7,5%Ga; 0,4%Ru; 0,2%Ge
19,3%Ag; 60,1%Pd; 7,5%Cu; 3,0%Sn; 0,2%Zn; 9,5%In; 0,2%Ir;
0,2%Ru
Для штампованных коронок и паяных мостовидных протезов
применяют сплав 916-й пробы, содержащий 91% золота, 4,5%
серебра, 4,5% меди или: золота 90%, серебра 4%, меди 6%. Сплав
обладает красивым желтым цветом, хорошей ковкостью, не
окисляется. Припой имеет следующий состав: золото 75%, серебро
3%, кадмий 12%, медь - остальное. Сплав 750-й пробы (проволока
и полосы для бюгельных работ) имеет следующий состав: золото
75%, платина 9%, серебро 8 %, медь - остальное. Для вкладок,
литых полукоронок, коронок
применяют золотоплатиновый сплав разных составов (%): 1)
золота 75, платины 4,15, серебра 8,35, меди 12,5; 2) золота
60, платины 20, серебра 5, меди 15; 3) золота 72, платины 12,
серебра 6, меди 10.
Безусловно, глядя на все эти выкладки по присутствию золота в
используемых металлах, в стоматологии всегда существовали
методы рафинирования и очистки золотосодержащих сплавов с
возможной переработкой технических отходов зубопротезного
производства. Для этих целей применялись как сухой, так и
мокрый способ рафинирования металла.
I. Сухие методы аффинажа золота
1. Рафинирование селитрой
Расплавленный высокопробный сплав золота обрабатывают калиевой
селитрой (KNO3). Металл плавится открытым пламенем
бензиновой или газовой горелки в жаропрочном керамическом
тигле с постоянным перемещением и помешиванием расплава
давлением пламени. Селитра подсыпается небольшими порциями в
расплав и после реакции, приводящей к пенообразованию и
вспучиванию получающихся оксидов наиболее
активных металлов находящихся в сплаве, расплав
пересыпается порцией буры. Цикл повторяется до тех пор пока вновь введённая порция
селитры не перестает создавать активное вспенивание и отшлаковывание оксидов. Этим способом
можно удалить следы свинца, висмута, кадмия, олова, цинка.
Образующиеся при этом окислы металлов примесей всплывают и,
сплавляясь с бурой, удаляются из тигля кварцевой или
керамической палочкой или же
сгоняются пламенем горелки за пределы плавильной зоны тигля.
2. Аффинаж при помощи хлора по методу
Миллера
Этот метод основан на следующем явлении: при прохождении через
расплав золотосодержащей массы газообразный хлор воздействует
прежде всего на металлы, которые снижают пробу золота и в
последнюю очередь на золото и платину. Примерный порядок
воздействия хлора на металлы: цинк, железо, сурьма, олово,
мышьяк, медь, свинец, висмут, серебро, теллур, селен, золото,
платина. Преимущество метода – доведение пробы золота за
несколько часов до 994-996‰, оборудование занимает мало места.
Недостаток – необходимость защиты оператора и окружающей среды
от воздействий хлора, ядовитого и коррозийного газа.
Применяется для золота пробой выше 700‰ с высоким содержанием
прежде всего серебра. Хлор, выходя из расплава уносит с собой
хлориды металлов, золото и другие соединения, которые в
больших или меньших количествах откладываются на внутренних
стенках вытяжной вентиляции.
II. Мокрые методы
1. Химические способы
аффинажа золота из лабораторных и технических остатков
1). Способ кратования.
Это самый простой способ, выделения золота из технических
остатков. Метод основан на инертности золота к действию
азотной кислоты. Остатки золотых сплавов: лом изделий, опилки,
стружки, обрезки и т.д. - необходимо, прежде всего,
прокипятить в разбавленной азотной кислоте, промыть, высушить
и сплавить. Сплавлять металл лучше в невысоком огнеупорном
керамическом тигле поместив его в муфельную печь или при
помощи газовой или бензиновой горелки, в смеси с бурой (1:1 объемн.%). Температура муфельной печи при
этом должна составлять 960-980°С. Если сплавление производится
открытым пламенем горелки, то очень мелкие опилки лучше
смешивать с порошком прокаленной буры (необезвоженная
бура сильно вспенивается при нагреве, что приводит к выносу
мелких опилок из плавильной зоны тигля). Опилки с бурой перед
помещением в плавильный тигель заворачиваются во влажную
бумажную салфетку или скатываются с мягким воском в небольшой
шарик. Получившийся после сплавления слиток металла
взвешивается и при этом желательно знать приблизительную пробу
сплава.
Эффективное и полное растворение в азотной кислоте всех прочих
составляющих сплав металлов (кроме золота и платины), возможно
лишь при условии если весовой % золота в сплаве будет
составлять лишь 1/4 его часть, т.е. проба сплава должна быть
не выше 250‰. Кратность такого сплава будет равна четырём. В
реальности квартование означает
уменьшение пробы драгоценного металла в сплаве. Достигается
это при помощи разбавления другим металлом (реагирующим с
азотной кислотой) путем сплавления.
Для простоты подсчёта процесса кратования
сплава можно воспользоваться следующей тактикой:
Если золота в полученном слитке составляет 500 весовых частей
(проба сплава = 500‰), то кратность его равна 2, и разбавлять
сплав нужно двумя весовыми частями меди (латунь, цинк);
Если проба первоначального слитка равна 750‰, то кратность
сплава в нём равна единице и добавить необходимо три весовые
части лигатуры, считая от первоначального веса слитка и, т.п.
...
Затем раскатованный расплав
выливают в воду для образования гранул (более мелких зёрен
металла). Воду сливают, а гранулы заливают разбавленной
азотной кислотой (до 2/3 объема реакционного сосуда). Вес
кислоты должен превышать вес металла в три раза. Сосуд
медленно нагревают (при протекании реакции выделяются ядовитые
пары двуокиси азота). При этом серебро, медь и другие примеси
растворяются, а золото остаётся в осадке. Для полного удаления
примесей полученный осадок повторно кипятят в чистой азотной
кислоте HNO3. После чего тёмно-бурый осадок металла
отстаивают и промывают несколько раз в воде до чистого слива.
Извлечённый из реакционной ёмкости порошок золота смешивают с
бурой (с малым её количеством), заворачивают в бумажную
салфетку, отжимают, плавят и получают слиток чистого золота.
Однако химический контроль, полученного квартованием
золота, показывает что аффинированный металл не имеет пробу =
999,9‰ и содержит некие доли примесей других металлов.
![]()
Рис 1.
Выход чистого металла в процессе аффинажа,
зная пробу и первоначальный вес (до кратования)
золотого сплава подвергшегося рафинированию, можно подсчитать
по несложной формуле (см. Рис 1.), где: Рсп
– вес сплава; Рч
– вес чистого золота; 0,°
- после запятой числовое значение пробы сплава.
Пример1. Первоначальный вес золотого сплава
подвергшегося рафинированию
Рсп • 0,° = Рч
10 • 0,585 = 5,85
Рч =
Эта же формула также позволяет вычислить -
сколько необходимо ввести в полученное чистое золото лигирующих металлов (Рл) для получения, например,
золотого сплава 900‰ пробы.
Пример2. Вес чистого золота равен
Рч : 0,° - Рч = Рл
5,85 / 0,900 - 5,85 = 0,65
Рл =
В конечном итоге получаем
2). Способ аффинажа из раствора
хлористого золота. Ввосстановление
золота сернокислым железом.
Применяемое для метода сернокислое железо FeSO4 в
виде зеленых кристаллов или кристаллического порошка должно
храниться в хорошо закрытых сосудах, в противном случае
сульфату железа (II) превращается в сульфат железа (III)
Fe2(SO4)3 коричневого цвета,
непригодного для использования. Сульфат растворяется в двойном
количестве воды, если жидкость мутная - это вызвано
превращением сульфата, что нежелательно. В общем случае
необходимы 3-
Золотосодержащие отходы плавят и гранулируют, вливая медленно
в воду. Полученные гранулы промывают и помещают в реакционную
ёмкость, в которой растворяют их царской водкой при нагревании
до 80-90°С и периодическом перемешивании до полного
прекращения реакции. Растворение идет по реакции:
Аu + 4НС1 + HNO3 = HAuCl, + NO + 2Н2О.
Полученный раствор декантируют и отстаивают в течение 4-6 ч
для коагуляции AgCl. Осадок AgCl отделяют от раствора фильтрацией,
а из осветленного раствора золото выделяют сульфатом железа,
порционно приливая приготовленный раствор FeSO4.
Ошибкой является считать, что достаточно добавить сульфат
железа к царской водке, содержащей золото для получения
качественного отделения желаемого количества металла. Никогда
нельзя полностью извлечь растворённое золото.
Наиболее экономически приемлемым методом является испарение
под вытяжным колпаком всего избытка кислоты – отфильтрованный
от хлорида серебра раствор медленно нагревается в реакционной
ёмкости из жаропрочного лабораторного стекла (лучше это делать
в фарфоровой лабораторной посуде), в которую для
предотвращения разложения хлорида золота добавляется
поваренная соль. Смесь выпаривают до получения густоты сиропа,
эта операция заслуживает внимание потому, что обеспечивает
наиболее полное отделение золота. Для ускорения процесса
рекомендуется периодически перемешивать раствор при помощи
стеклянной палочки, добавляя время от времени небольшое
количество соляной кислоты. Жидкость с густотой сиропа
охлаждается, добавляется небольшое количество соляной кислоты,
три объема воды и фильтруется. Фильтр промывается водой,
которая выливается в отфильтрованную жидкость и уже к ней
добавляется сульфат железа. Золото, полученное при помощи
сульфата железа имеет вид красно-коричневого тяжёлого порошка,
который оседает на дно сосуда, затем фильтруется, промывается
водой. Золото собирается на бумажном фильтре, который затем
сжигается. Если все операции проведены правильно, извлекается
всё золото, а получившийся металл имеет пробу 999,9‰.
Для того чтобы быть уверенным, что вместе с отработанными
жидкостями не выливается также и золото, к ним всегда
добавляется немного сульфата железа и наблюдается появления
бурого осадка металла в растворе и только в случае отсутствия,
которого, раствор выливается.
3). Осаждение золота солянокислым
гидразином.
Осветленный раствор золота соединяют с солянокислым гидрозином. Реакция идет по формуле:
4НАuСl4 + 3N2H4(HCl)2 = 4Au + 3N2
+ 22HCl.
Образовавшийся золотосодержащий осадок промывают горячей деионизированной водой, а потом
10%-ным раствором NH4OH для отмывки от следов AgCl с образованием растворимого в
воде комплекса:
AgCl + 2NH4OH = Ag(NH3)2Cl + Н2О
.
После этого осадок промывают 5-10%-ным раствором H2SO4,
для отмывки от железа и меди. Отмывку золота от серебра, меди
и железа проводят дважды. Полученный осадок фильтруют, сушат
при 150-200°С, плавят с селитрой при 1250°С и разливают в
слитки.
4). Переработка шлифовальных
золотосодержащих порошков.
Сбор шлифовальных отходов производится в пылеулавливателе или
же со шлифовальных резинок в невысокий плоский эмалированный
лоток с водой, размещённым в процессе шлифовки изделий около электрошлифмотора в зоне основного
потока сброса отходов от вращающегося абразива. Исходное сырье
не высушивают для предотвращения разбрызгивания. Влажные
золотосодержащие шлифпорошки
загружают в реакционную ёмкость для растворения золота, после
чего добавляют раствор азотной и соляной кислот при
соотношении 1:5. Золото растворяется в течение 3-4 ч при
80-100°С. По окончании растворения пульпа из реакторов
сливается на фильтр. Из отфильтрованного золотосодержащего
раствора производят осаждение золота солянокислым гидразином
(N2H2 • HCl),
содержащим медный порошок, который добавляют к основному
восстановителю золота - гидразину - для уменьшения общей
кислотности, удаления азотной кислоты и предотвращения
обратного растворения золота: Сu
+ 4HNO3 = Cu(NO3)2
+ 2NO2 + 2Н2О.
Операции осаждения и последующего отстаивания золота занимают
около 5 ч, после чего пульпу фильтруют.
Осадок после трех-четырех промывок горячей водой сушат в
электропечи при 100-300°С и плавят в тигле в печи.
5). Восстановление золота из
фотографических остатков.
Для использования фотографических или аналогичных остатков,
содержащих золото в малых концентрациях, рекомендуется
следующий способ.
В раствор добавляют Na2CO3 до щелочной
реакции, после этого его смешивают со спиртовым раствором
анилина и оставляют стоять на солнечном свету не менее чем на
8ч. При этом золото полностью выпадает на дно.
6). Переработка изделий из цветных
металлов и сплавов, покрытых золотом.
В радиотехнической и электронной промышленностях образуются
отходы изделий из цветных металлов и их сплавов, покрытых
золотом. В последние годы в промышленности особенно
увеличилось количество отходов, содержащих золото на
вольфрамовой или молибденовой основе. Толщина золотых покрытий
невелика (0,1-24 мкм), однако содержание золота в них
достигает 20%.
Наиболее перспективной переработкой таких отходов является
избирательное растворение золотого покрытия. В качестве
инертного растворителя к материалу основы могут быть
использованы растворы тиомочевины,
роданистого аммония или йода.
В последнем случае используют раствор йода в водном растворе
йодистого калия. Золото в полийодидном
растворе образует комплекс K[AuI4] или K[AuI2].
Для снятия золота сырье подвергают электрохимической обработке
в полийодидном растворе,
содержащем 180-250г/л KI и 200г/л I2.
Для растворения и извлечения золота из образовавшегося
раствора используют реакторы, в которых анодное и катодное
пространства разделены с помощью диафрагмы из пористого
материала. Наиболее подходящим материалом для диафрагмы служит
керамика с порами величиной 0,0001-0,001мм при толщине стенок
8мм. Пористая диафрагма при электролитической обработке полийодидного раствора разделяет
продукты электродных реакций и предотвращает обратное
растворение губчатого золота, выделившегося на катоде в
травильном растворе. Электроды для электрохимического
выделения золота изготавливают из стеклоуглерода.
Процесс электролитического выделения золота ведут при
напряжении 4-5 В, плотности тока 20-30 А/дм2 в
течение 2-3 ч, расход электроэнергии 0,2-0,4 кВт•ч на 1г
золота. Извлечение золота достигает 99-99,8%.
III. Электролитический аффинаж
Этот аффинаж проводится предприятиям, которые имеют постоянное
количество золота с пробой не менее 900‰. Аффинаж дает хорошие
результаты, если количество серебра не превышает 100 тысячных
%. Анодом служит рафинируемое золото, катод должен быть
изготовлен из чистого золота. Электролит состоит из хлорного
золота и соляной кислоты.
Палладий (Palladium). Атомная
масса палладия 106,4; плотность при 20°С 12,0 г/см3;
температура плавления 1554°С; температура кипения 4000°С.
Назван в честь астероида Паллас. Палладий серебристо-белый
металл, самый легкий из платиновых металлов, наиболее мягкий и
ковкий. В сплавах с другими металлами применяют для ювелирных
изделий, химической аппаратуры, зубопротезирования;
катализатор многих химических реакций, в том числе
гидрирования. Он замечателен своей способностью поглощать
огромное количество водорода (до 900 объемов на 1 объем
металла). При этом палладий сохраняет металлический вид, но
значительно увеличивается в объеме, становится ломким и легко
образует трещины. Поглощенный палладием водород находится,
по-видимому, в состоянии, приближающемся к атомарному, и
поэтому очень активен. Насыщенная водородом пластинка палладия
переводит хлор, бром и йод в галогеноводороды,
восстанавливает соли железа (III) в соли железа (II), соли
ртути (II) в соли ртути (I), диоксид серы в сероводород.
Россия является крупнейшим в мире производителем палладия - на
её предприятиях сосредоточено около 50% мирового производства.
Добыча палладия в 1999 году: Россия - 155,5 т/год; ЮАР - 58,7
т/год; прочие - 24,2 т/год. Начиная с 1972 года, палладий
находит всё более широкое применение в автомобильной
промышленности, в частности, в производстве нейтрализаторов
выхлопных газов автомобильного транспорта, с чем и были
связаны самые "шумные дела" последних лет на мировом рынке.
Выписка из газеты "Коммерсантъ" за 12.01.2001 г: "Две трети
объемов данного металла, реализуемых на мировом рынке,
поступает из России. Однако в этом году наша страна не
поставила ни унции палладия. Более того, дилеры не имеют ни
малейшего представления о том, когда же возобновятся поставки.
В результате цены уже зашкаливают за $1100 за унцию.
Автопроизводители (палладий используется ими в катализаторах
для очистки выхлопных газов) не раз заявляли, что такая цена
их не устраивает. Автогиганты во главе с General
Motors объявили о разработке
нового катализатора на основе более дешевой платины.
Несмотря на длительные сроки внедрения новых технологий,
дилеры уже сейчас подняли цену на платину до максимального за
последние 13 лет уровня - $645 за унцию. И если Россия
потеряет большую часть рынка сбыта палладия, то она, оставаясь
одним из крупнейших игроков платинового рынка, сможет
компенсировать потери от снижения спроса на палладий
дополнительными поставками платины".
Так что в связи с некоторым бойкотом, Россия всё-таки была
вынуждена снизить поставки металла, но на сегодняшний день уже
старается вернуть свои прежние позиции и увеличила поставки
палладия на мировые рынки в
Соединения палладия малотоксичные, а его комплексные
соединения с органикой обладают исключительными биологическими
свойствами, но в медицинских целях применение палладия
неоправданно ограниченно и, видимо, также из-за его
исключительной особенности поглощать в больших объёмах
водород, что делало этот металл до недавнего времени
малодоступным и для более широких медико-биологических
исследований. Основное применение палладия приходилось на
военно-промышленный комплекс, и космическую промышленность.
Его способность разделять изотопы водорода и отделять от него
дейтерий и тритий, очень были кстати на стадии гонки
вооружения при производстве ядерного и термоядерного оружия.
Однако эти времена, к счастью, проходят, а палладий со своей
исключительностью остаётся и находит всё более широкое
применение во многих отраслях народного хозяйства во всём
мире.
В химическом отношении палладий отличается от других
платиновых металлов значительно большей активностью. При
нагревании до красна он соединяется с кислородом, образуя
оксид PdO; растворим в соляной
кислоте в присутствии окислителей; при нагревании растворяется
в HNO3 и H2SO4. Тонкая фольга
из проката палладия проницаема для водорода. Коллоидный
палладий в сухом состоянии устойчив. При диспергировании в
воде твердый продукт (содержащий ~50% Pd)
способен поглощать объем водорода, в 3000 раз превышающий
собственный. Палладиевая чернь мелкодисперсный порошок
глубокого черного цвета, поглощает 870 объемов водорода на 1
объем, а в виде водной суспензии - до 12000.
В СССР палладий имел более широкое распространение в
ортопедической стоматологии. Из его сплавов с серебром и
золотом изготавливались коронки и паяные мостовидные протезы,
такие сплавы обладают хорошими технологическими качествами. В
большинстве таких сплавов серебро является основой, палладий
придает им коррозионную стойкость. В России применяют
следующие сплавы:
ПД-250 (палладий - 24,5%, серебро - 72,1%);
ПД-190 (палладий - 18,5%, серебро - 78,0%);
ПД-150 (палладий - 14,5%, серебро - 84,1%);
ПД-140 (палладий - 13,5%, серебро - 53,9%).
Кроме серебра и палладия сплавы содержат небольшие количества
легирующих элементов. Используются металлы: медь, алюминий,
олово, висмут, сурьма, свинец, кадмий, цинк, магний.
Для улучшения литейных качеств и защиты от нежелательных
свойств серебра (коррозия) в сплав добавляют золото. В
настоящее время применяется сплав из серебра - 72%, палладия
- 22%, золота - 6%. Он особенно удобен для
изготовления литых вкладок, креплений для фасеток в
мостовидных протезах. Сплавы на основе серебра и палладия
имеют температуру плавления около 1100-1200°С.
I. Методы получения чистого металлического
палладия
1. Способ аффинажа из технических
остатков
1). Палладиевая губка. Технический
палладий, содержащий другие тяжелые металлы, растворяют в
царской водке. Затем удаляют азотную кислоту при упаривании с
избытком соляной (см. методику упаривания р-ра до густоты сиропа - пункт zII.1.2).
Остаток растворяют в соляной кислоте, раствор обрабатывают
избытком аммиака, причем первоначально выпавший
кроваво-красный осадок [Pd(NH3)4]
[PdCl4] (соль Вокелена)
растворяется с образованием бесцветного [Pd(NH3)4]Cl2.
Гидроксиды других металлов отфильтровывают и к раствору
добавляют соляную кислоту. При этом выпадает желтый [РdСl2(NH3)2].
Его
отделяют на фильтре, промывают разбавленной соляной кислотой и
снова растворяют в аммиаке. Эту операцию очистки повторяют до
получения препарата необходимой степени чистоты. Наконец,
[РdСl2(NН3)2] прокаливают в
индукционной печи для получения палладиевой губки, затем
сплавляют с добавлением буры. Многократная обработка аммиаком
может привести к нежелательному появлению примеси SiO2
в палладии.
2). Технические остатки
растворяют в азотной кислоте при нагревании. Для удаления
серебра в полученный смесь азотнокислых солей металлов
добавляют раствор NaCl до такой
степени, чтобы AgCl практически
полностью выпал в осадок. После декантации и фильтрования
осветлённый раствор кипятят до полного выделения оксидов
азота, а затем к нему приливают насыщенный раствор NH4Cl.
После пропускания хлора из раствора выпадают блестящие красные
кристаллы (NН4)2[РdСl6]. Их
отфильтровывают и промывают раствором NH4Cl. Из
полученной соли можно путем прокаливания получить палладиевую
губку либо для очистки еще раз перекристаллизовать
ее путем осаждения соляной кислотой из аммиачного раствора и
прокалив, сплавить с бурой в слиток.
2. Получение коллоидного палладия
2 г протальбината натрия
растворяют в 50 мл 0,5 н. раствора NaOH
и медленно добавляют раствор Na2[PdCl4]
(полученный при растворении
3. Получение палладиевой черни
Восстановление водных растворов солей Pd(II)
(например,
Na2PdCl4 формиатом натрия или
гидразингидратом происходит медленно при комнатной температуре
и очень быстро >50°С. Изменяя температуру, концентрацию и
рН раствора, можно получать продукты самой различной
дисперсности.
4. Регенерация палладия из остатков
электролитов
В качестве восстановителя палладия из раствора электролитов
рекомендуется использовать муравьинокислый натрий. Регенерацию
производят следующим образом: электролит подкисляют соляной
кислотой до рН 1.0 и нагревают до кипения. В горячий раствор
добавляют муравьинокислый натрий из расчета 5-
Платина (Platinum). Атомная
масса палладия 195,09; плотность при 20°С 21,45 г/см3;
температура плавления 1773,5°С; температура кипения ~4000°С
В природе платина, подобно золоту, встречается в россыпях в
виде крупинок, всегда содержащих примеси других платиновых
металлов. Содержание платины в земной коре оценивается всего в
5•10-8%(масс.).
Платина - белый блестящий ковкий металл, не изменяющийся на
воздухе даже при сильном накаливании. Отдельные кислоты на нее
не действуют. Платина растворяется в царской водке, но
значительно труднее, чем золото.
Самородная платина и ее сплавы с серебром и другими металлами
под названием "белое золото" были известны еще в глубокой
древности (в Египте, в 19 в. до н.э.), но до 2-й половины 18
в. не находили применения.
Первое упоминание в литературе о платине относится к
Название нового металла "платина" произошло из испанского
слова plata, обозначающего
серебро, вследствие внешнего сходства этих металлов.
Дальнейшие исторические сведения о платине относятся к
Использование платины осложнялось трудностью ее расплавления и
отсутствием методов очистки ее от примесей и получения ковкого
металла. Впервые платину начали аффинировать в 70-х годах 18,
в. В 1773-74 гг. Де Лиль получил ковкую платину.
В
В
В России начало платиновой промышленности относится к
С открытием платиновых россыпей в России усилились работы по
аффинажу платиновых металлов. В 1825-26 гг. Архипов, Иосса и Сысоев изготовили изделия
(кольца, цепочки и др.) из платины, аффинированной по способу
Жанетти. В
Разработка уральских платиновых россыпей имела исключительно
большое значение для развития мировой платиновой
промышленности. За период с 1820 по 1917 гг. из общей добычи
платины, которая ориентировочно оценивается в 260-350 т, на
долю России приходится 220-315т, т.е. около 85-90%.
С 1867г. аффинаж платины в России был прекращен и до
В 1913-1916 гг. был построен аффинажный платиновый завод в г.
Екатеринбурге, на котором начали получать губчатую платину, но
выпуск аффинированных платиновых металлов на этом заводе был
осуществлен позднее: в 1923г. - платины, палладия, иридия, в
1925г. - золота, в 1926г. - осмия и в 1930г. - рутения.
В настоящее время платиновые россыпи Урала приближаются к
истощению. Основную массу платиновых металлов в России
получают на Норильском Никеле, который обеспечивает примерно
20% платины на мировом рынке металлов.
В зарубежных странах добыча платиновых металлов значительно
возросла после 1-й Мировой войны и к 1957г. составила 33,1т и
далее продолжала возрастать, достигнув в настоящее время более
100т/год. Основными производителями платиновых металлов за
рубежом являются ЮАР и Канада, которые добывают около 98% этих
металлов.
Основными потребителями платины являются все отрасли
научно-технических производств.
Ввиду тугоплавкости и высокой химической стойкости платины из
нее изготовляют лабораторную посуду: тигли, чашки, нагреватели
и т. п. В химической промышленности платину применяют в
качестве катализатора в органическое и неорганической
технологиях. В электротехнической промышленности, электронике
и приборостроении платина и сплавы применяются при
изготовлении контактов, электросопротивлений, потенциометров,
плавких предохранителей, электродов рентгеновских трубок,
аппаратов связи, деталей астрономических приборов и др. Сплавы
платины с кобальтом используются для получения мощных
постоянных магнитов. В стекольной промышленности платину и её
сплавы с родием применяют при изготовлении оптического стекла
высокой степени чистоты, не содержащего примесей железа.
Новой областью потребления платины является автомобильная
промышленность, где этот металл используются для оснащения
автомобилей специальными устройствами по очистке выхлопных
газов от вредных примесей. Средний расход платины на
изготовление одного фильтра нейтрализатора (70% Pt и 30% Pd)
составляет
В медицине платину и ее сплавы применяют для изготовления игл,
шприцев, наконечников и других деталей, а также некоторых
медикаментов. В ортопедической стоматологи всё шире
развивается протезирование золотоплатиновыми сплавами. Платина
вводится в золотые сплавы для повышения температуры плавления
и придания сплаву большей механической прочности, что является
основными условиями использования золотых сплавов для
изготовления металлокерамических и бюгельных конструкций.
Платина, полученная из концентратов или промышленных и
лабораторных отходов, содержит примеси металлов-спутников
платины, а также золото, медь и железо, повторные и более
тщательные методы аффинажа позволяют получить чистый металл.
I. Методы аффинажа платины
1. Способ аффинажа царской водкой
Сырую платину в виде мелкой стружки или губки растворяют в
царской водке. Для удаления азотной кислоты раствор несколько
раз выпаривают почти досуха, каждый раз растворяя остаток в
разбавленной соляной кислоте. К прозрачному раствору, не
содержащему нитратов, добавляют стехиометрическое количество NaCl, чтобы перевести всю содержащуюся
в растворе платину в Na2[PtCl6]. Избыток
соляной кислоты удаляют выпариванием. Раствор доводят до
концентрации платины 50г/л. Если в нем содержится золото,
добавляют несколькими порциями FeSO4 до полноты
осаждения металла. После отстаивания золотосодержащий шлам
отделяют декантацией. Прозрачный раствор нагревают почти до
кипения и добавляют твердый NaHCO3 до рН 5-6, а
затем немного твердого NaBrO3. Если при этом
выделяется бром, следует вновь нейтрализовать раствор
бикарбонатом. Описанные операции повторяют до тех пор, пока не
прекратится выделение брома. На каждые 100г сырой платины,
содержащей 5-10% примесей, следует добавить 10-12г NaBrO3.
В случае более чистого исходного материала вводят
соответственно меньшее количество бромата
натрия. После добавления всего требуемого количества бромата с помощью 10%-ного раствора
NaHCO3 доводят рН раствора до 6,5. Смесь кипятят в
течение часа, контролируя рН каждые 10 мин. Если рН становится
меньше 6, снова добавляют NaHCO3. Затем раствор по
возможности быстро охлаждают; гидроксиды, как правило, хорошо
осаждаются. Прозрачный раствор декантируют, а затем фильтруют.
К нему добавляют соляную кислоту до рН 0,5-1 и кипятят для
разложения избытка бромата. (NH4)2PtCl6
осаждают при температуре кипения добавлением раствора NH4Cl
(насыщенного
на холоду). По охлаждении раствора до комнатной температуры
слегка желтоватый осадок соли отфильтровывают, промывают
5%-ным раствором NH4Cl и сушат. Соль прокаливают до
платиновой губки, которую затем кипятят с водой для полного
удаления хлорида натрия и еще раз прокаливают. Описанная
методика очистки весьма эффективна. При содержании в исходном
материале 90-95% Pt после
однократного цикла очистки получают металл, содержащий
99,98-99,99% Pt.
2. Рафинирование лабораторных
платиновых остатков
Остатки, в которых предполагается присутствие платины
(лабораторные плавы,
использованные фильтры), металлические отходы и стружка,
прежде всего прокаливают при высокой температуре, а затем
просеивают через мелкое сито. Частицы железа удаляют из
"грубой" фракции после просеивания с помощью магнита, затем Pt кипятят в разбавленной азотной
кислоте (для растворения меди и латуни). "Тонкую" фракцию
кипятят с разбавленной соляной кислотой и снова прокаливают.
Затем обе фракций растворяют при кипячении в царской водке. Не
растворившийся остаток отфильтровывают, прокаливают вместе с
фильтром и восстанавливают водородом, после чего снова при
кипячении растворяют в царской водке.
Фильтраты, полученные после растворения отдельных фракций в
царской водке, объединяют и упаривают до сиропообразной
консистенции, а затем добавляют в полученный раствор немного
разбавленной соляной кислоты. При работе с большими
количествами остатков выпаривание для удаления оксидов азота
повторяют несколько раз. К раствору, не содержащему нитратов,
добавляют 10%-ный раствор NH4Cl, осадок (NН4)2[РtСl6]
отфильтровывают и промывают раствором NH4Cl, а
затем прокаливают до образования платиновой губки.
3. Платиновая чернь из ненасыщенных
растворов
1). Водный раствор,
содержащий 2% платины в виде H2[PtCl6]•xH2O,
нагревают и нейтрализуют Na2CO3. Этот
горячий раствор медленно вливают при перемешивании в кипящий
10%-ный раствор формиата натрия. Тотчас же выделяется черный
осадок, который фильтруют и промывают декантацией горячей
водой. Полученный осадок отсасывают и сушат над P4O10
или конц. H2SO4.
2). Для восстановления
можно применять также N2H6Cl2,
однако в этом случае необходимо работать при значительном
разбавлении раствора и на холоду, иначе выпадает серая платина
или даже образуется платиновое зеркало. При восстановлении
твердого K2[PtCl6] водородом в трубчатой
печи при 200-250°С после отмывки КСl
можно получить платину в виде тонкого порошка глубокого
черного цвета.
3). Остатки, содержащие
K4[PtCl6] и спирт, выпаривают досуха, осадок растворяют в воде
и полученный раствор вливают в раствор NaOH
(d=1,2), в который добавлено 8% глицерина. Смесь нагревают до
кипения, при этом платина выпадает в виде черного порошка; его
промывают сначала водой, затем НСl,
потом снова водой и прокаливают.
4. Методы цементации из растворов
1). Маточный раствор и
промывные воды содержащие платину сливают, приливают избыток
соляной кислоты, а затем восстанавливают платину
гранулированным цинком (цементация). Полученный осадок снова
растворяют в царской водке, к раствору добавляют NH4Cl,
осадок (NH4)2PtCl6
прокаливают и вместе с полученным ранее металлом очищают от
примесей по методике, приведенной приведённой в вышеописанных
методах.
2). Отработанные растворы
различных соединений платины, собранные в специальных сосудах,
содержат производные элементов в различных степенях окисления.
Их прежде всего освобождают от органических растворителей
(спиртов, уксусноэтилового эфира
и т. д.) отгонкой с водяным паром. Затем к растворам добавляют
избыток соляной кислоты (иногда серной) и проводят цементацию
благородных металлов гранулированным цинком при кипении
раствора. Полученную таким образом сырую платину всегда
подвергают дополнительной очистке путем растворения в царской
водке с последующим осаждением сероводородом.
***
Работа с платиной по её прокалке или
сплавлению в компактную форму требует аккуратности. Особенно
опасен контакт Pt со свободным
SiO2 в присутствии восстановителей, таких, как газ
пламени, активированный уголь и т. д. Образующиеся сплавы
платины с кремнием вызывают характерный кремниевый излом.
Необходимо обращать особое внимание на чистоту как внутренних,
так и наружных стенок и дна тиглей и чашек. Следует избегать
применения тигельных щипцов из неблагородных металлов без
платиновых наконечников, нельзя ставить раскаленную платиновую
посуду на загрязненные подставки или пластинки, а также сетки
из неблагородных металлов.
Предельная температура, выше которой начинается заметная
коррозия Pt, как правило,
составляет ~700°С. Для плавов, которые содержат КОН, Ва(ОН)2, пероксиды и
цианиды, эта температура снижается до 500-600°С, а для
карбонатов или нейтральных солей возрастает до 800°С и выше.
Восстановленную платину во избежание соединения с оксидом
кремния лучше прокаливать и сплавлять в специальных тиглях
изготовленных из Са(ОН)2
или же футерованных гидроксидом кальция.
В начале 19-го столетия человечество стояло поистине на пороге
грандиозного технического прогресса, открытий и изобретений и,
конечно же, это также коснулось и благородных металлов. Если с
особой исключительности платины разобрались много ранее, то
вот с ближайшими её сопутствующими родственниками, это
пришлось сделать только теперь.
В
Все металлы этой группы обладают незаменимыми свойствами, что
находит своё применение во многих отраслях и производствах,
особенно там, где требуется свехточность
и термостойкость к среде применения, изготовляемых из них
деталей приборов и механизмов.
Рутений применяется в приборостроении при изготовлении
деталей, требующих весьма высокой прочности. Сплавы осмия с
иридием отличаются большой твердостью и идут на изготовление
точных измерительных инструментов - астрономических и
мореходных.
Термопары из платины и ее сплавов с родием (10-40% Rh) применяются для длительных
измерений высоких температур (1300-1800°С). Сплав, состоящий
из 40% Ir и 60% Rh, пригоден для измерения весьма
высоких температур - до 2000-2300°С.
Особые свойства родия, обладающего высокой отражательной
способностью, позволяют использовать его для покрытия
рефлекторов, в частности это важно для прожекторов. Эти
покрытия устойчивы против механических повреждений и
выдерживают температуру свыше 400°С.
Родий, иридий, рутений и осмий, как правило, применяются в
сплавах с платиной и палладием. В основном эти металлы
используются в химической промышленности.
Из иридия изготовляют тигли, выдерживающие температуру до
2300°С. Стойки электрохимические и химические покрытия из
иридия толщиной - менее
Иридий (Iridium). Атомная
масса иридия 192,22; плотность при 20°С 22,5 г/см3;
температура плавления 2443°С; температура кипения
>4150°С.
Твердый, довольно хрупкий металл. При прокаливании на воздухе
>700°С образует летучий IгO3, так что при
окислительном обжиге масса иридия и его сплавов уменьшается.
Очень устойчив к действию минеральных кислот, царской водки и
анодному окислению. При более высоких температурах реагирует с
хлором, особенно в присутствии хлоридов щелочных металлов, с
образованием более или менее растворимых комплексов -
[IrCl6]3- и [IrCl6]2-.
Чистый металлический иридий
Технический иридий в смеси с NaCl
многократно хлорируют н обрабатывают царской водкой для
превращения в (NН4)2[IгСl6]. Таким
образом количественно удаляют неблагородные металлы, а также Ag, Au и
Pd. Однако очистку от Ru, Pt и
особенно Rh осуществить при этом
не удается. Для их отделения (NН4)2[IгСl6]
растворяют в царской водке с образованием H2[IrCl6].
К раствору H2[IrCl6] добавляют
стехиометрическое количество NaCl:
H2[IrCl6] + 2NaCl —> Na2[IrCl6]
+ 2НСl
Полученный раствор должен иметь концентрацию по иридию 100 г/л
и содержать 35 мл конц. НСl в 1л. Раствор при комнатной
температуре в течение нескольких дней (лучше недели или
дольше) насыщают сероводородом. При этом красно-коричневый
раствор светлеет из-за восстановления Ir(IV)
в Ir(III), а сульфиды Pt, Rh и
Ru выпадают в осадок [вместе с
незначительным количеством сульфида Ir(III)].
Отсутствие примеси Rh в пробах
раствора устанавливают спектральным анализом восстановленного
металлического иридия. При отсутствии Rh
раствор фильтруют, разбавляют, затем окисляют Ir(III) в Ir(IV),
добавляя небольшие количества HNО3, Сl2
или Н2O2. При действии NH4Cl
снова осаждается (NН4)2[IгСl6].
Для определения момента окончания реакции требуется некоторый
опыт восстановления растворов Ir(IV)
сероводородом до Na2[IrCl6] - без
образования сульфидов. Получают иридий высокой чистоты с
выходом >80%. Термическое разложение (NН4)2[IгСl6]
начинается >200°С. Выше 700 °С реакция Ir с кислородом приводит к потерям
металла вследствие образования газообразного IгO3.
Таким образом, разложение хлороиридата
аммония следует проводить, медленно повышая температуру от 200
до 500°С.
Осмий (Osmium).
Атомная масса осмия 190,2; плотность при 20°С 22,61 г/см3;
температура плавления 3050±30°С; температура кипения
~5000°С.
Очень твердый и хрупкий металл. Поверхность порошка осмия
окисляется кислородом и имеет запах, характерный для OsO4.
При нагревании порошок осмия горит с
образованием OsO4. Компактный переплавленный
металл окисляется на воздухе при температуре >400°С. Осмий
реагирует с HF, а также Cl2 уже при 100°С, почти не
растворяется в минеральных кислотах и царской водке.
Чистый металлический осмий
Тонкоизмельчённый продукт, содержащий осмий, сплавляют со
смесью КОН и KNO3 (5:3). Плав растворяют в воде и
раствор переносят в прибор для перегонки (на шлифах).
Перегонная колба снабжена капельной воронкой, трубкой для
ввода газа и дефлегматором. В колбу добавляют по каплям НNО3
до кислой реакции. Выделяющийся газообразный OsO4
перегоняют в токе воздуха или кислорода в приемник, где он
поглощается 10%-ным раствором КОН. Промывные склянки,
расположенные после приемника, также заполняют 10%-ным
раствором КОН. В конце процесса нагревают раствор до кипения,
чтобы отогнать последние остатки OsO4. Полученный
раствор К2[OsO4(ОН)2] в
зависимости от концентрации окрашен от красно-коричневого до
желтого цвета. Его слегка нагревают и медленно высаливают
фиолетовый K2[OsO2(OH)4]
96%-ным спиртом. Раствор оставляют на ночь для завершения
кристаллизации, осадок осмата
(VI) переносят на фильтр, промывают небольшим количеством
спирта, отсасывают досуха и сушат при температуре <100°С. K2[OsO2(OH)4]
восстанавливают водородом при высокой температуре до порошка
металлического осмия. Его промывают горячей водой и еще раз
прокаливают в токе водорода.
Родий (Rhodium). Атомная
масса родия 102,9055; плотность при 20°С 12,41 г/см3;
температура плавления 1960°С; температура кипения 3700°С
Блестящий серебристый металл - более твердый, чем платина и
палладий, труднее поддается обработке. При температуре
красного каления устойчив к действию кислорода воздуха, но
реагирует с хлором. Не растворяется в кислотах и даже в
царской водке. При сплавлении с KHSO4 медленно
переходит в раствор. При температуре красного каления
коррозирует в атмосфере хлора.
Чистый металлический родий
Химически чистый родий получают по следующей методике.
Измельченный металл тщательно смешивают с полуторакратным (по
массе) количеством NaCl и
пропускают хлор в течение 2-4 ч при температуре 600°С. Затем
смесь охлаждают в токе хлора и плав обрабатывают водой. Не
растворившийся остаток хлорируют снова до тех пор, пока весь
родий не перейдет в растворимое состояние. Раствор разбавляют
до концентрации Rh 40г/л, и
нагревают на водяной бане. Добавляют NaNO2 до
перехода окраски раствора из красной в желтую (для этого
требуется 500-
Рутений (Ruthenium). Атомная
масса рутения 101,07; плотность при 20°С 12,3 г/см3;
температура плавления 2500°С; температура кипения
>4200°С.
Чистый металлический рутений
30 г неочищенного рутения измельчают в порошок, засыпают в
лодочку тонким слоем и нагревают в токе О2 ~ 3 часа
при температуре темно-красного каления - до практически
полного удаления содержащегося в металле осмия (в виде
летучего OsO4). Охлаждают лодочку в атмосфере
инертного газа, и частично окислившийся рутений
восстанавливают в токе водорода при нагревании.
Порошок частично очищенного рутения сплавляют в серебряной
чашке с КОН ("ос. ч.") и NaNO3 ("ос. ч.") (в масс.
отношении 1:4:1). При этом образуется прозрачный ярко-зеленый
расплав рутеиата (VI). Его
нагревают еще в течение получаса, затем охлажденный продукт
разбивают на мелкие кусочки, переносят в большую перегонную
колбу и растворяют в теплой воде. Колбу присоединяют к
установке для перегонки (на шлифах); в приемнике находится
2,5н. раствор НСl. Конец
холодильника расположен над уровнем кислоты, за ним следуют
промывные склянки также с раствором 2,5н. НСl.
При пропускании хлора в оранжево-красный раствор M2RuO4
наблюдается нагревание и раствор становится зеленым в
результате окисления до MRuO4, а затем до RuO4.
Последний током хлора переносится в холодильник, где
конденсируется в виде желто-оранжевых капель, а затем
застывает. При нагревании в токе Сl2 весь RuO4
перегоняется с образованием в приемнике темно-коричневого
раствора.
Содержимое приемника и промывных склянок объединяют и
упаривают на роторном испарителе при температуре водяной бани.
Полученный концентрированный раствор фильтруют. К фильтрату
приливают насыщенный на холоду раствор NH4Cl.
Выпавший темно-красный кристаллический осадок (NH4)3[RuCl6]
(содержащий также (NH4)2[RuCl5(OH)])
отсасывают
и промывают на фильтре 20%-ным раствором NH4Cl.
Соль восстанавливают водородом при ~1000°С с образованием
порошка чистого рутения.
На этом можно было бы и закончить
повествование о металлах, которые за всё время своего
существования вносили существенные правки в жизни многих людей
и народов, благодаря особой красоте и исключительности свойств
каждого из представителей этой группы благородного семейства.
Однако, как можно было уже убедиться – благородные металлы,
входящие в составы технических сплавов часто имеют таких же
благородных спутников, но которые в той или иной мере могут
загрязнять конкретный металл своим присутствием и, стало быть,
любой метод аффинажа конкретного металла из таких сплавов чаще
требует комплексный подход к методам очистки.
По сути, алгоритмы химических процессов для разделения любого
сплава по его отдельным благородным составляющим не сложен.
Зная методы извлечения каждого из них, данный процесс можно
легко представить, как логическую игрушку по раскладыванию
цветных фигурок по свойствам и образам. Но я всё же покажу
конкретный пример с этапами извлечения каждого металла в
отдельности из их общего благородного состава сплава.
Возьмём, к примеру, сплав в состав которого входят (помимо
прочей не интересующей нас неблагородной составляющей) – Au; Ag;
Pt и Pd.
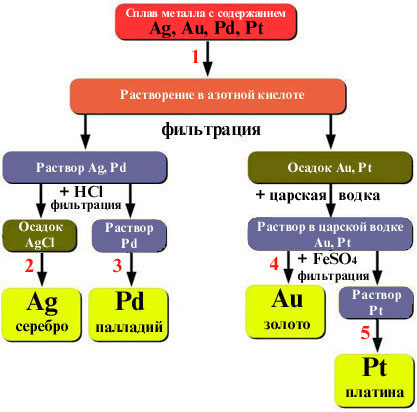
Первое (1) –
металл готовится способом кратования
с учётом общей кратности содержания в сплаве не только золота,
но платины. После растворения и фильтрования от осадка
металлов Au и Pt, в осветлённый раствор смеси солей
Ag и Pd
вливается соляная кислота да полного осаждения хлорида
серебра. Отфильтрованный осадок AgCl
восстанавливается до чистого серебра (2)
любым из химических
способов. Затем из осветлённого раствора соли палладия (3) восстанавливается и
металлический палладий по описанному методу, например, "палладиевая
губка" или 4. Далее – первоначально
отфильтрованные из азотной кислоты металлы (Au, Pt)
подвергаются растворению в царской водке для аффинажа золота
из полученного раствора (4) спобом сернокислого железа.
Осадок металлического золота отфильтровывается, а оставшаяся в
растворе платина также подвергается восстановлению (5) любым наиболее удобным химическим
методом и является конечным продуктом предложенного
комплекса рафинирования.
Октябрь,
www.dfa.ru